プロジェクトの紹介
目標:
膵β細胞、脳神経細胞などを研究対象として、その高次機能構築機序を分子生物学的、細胞生物学的手法を用いて解析し、その機能不全あるいは細胞障害によって生じる病態を感知、制御する方法を開発する。
現在進行中のプロジェクト:
1. 細胞の生存増殖と細胞死シグナルの研究
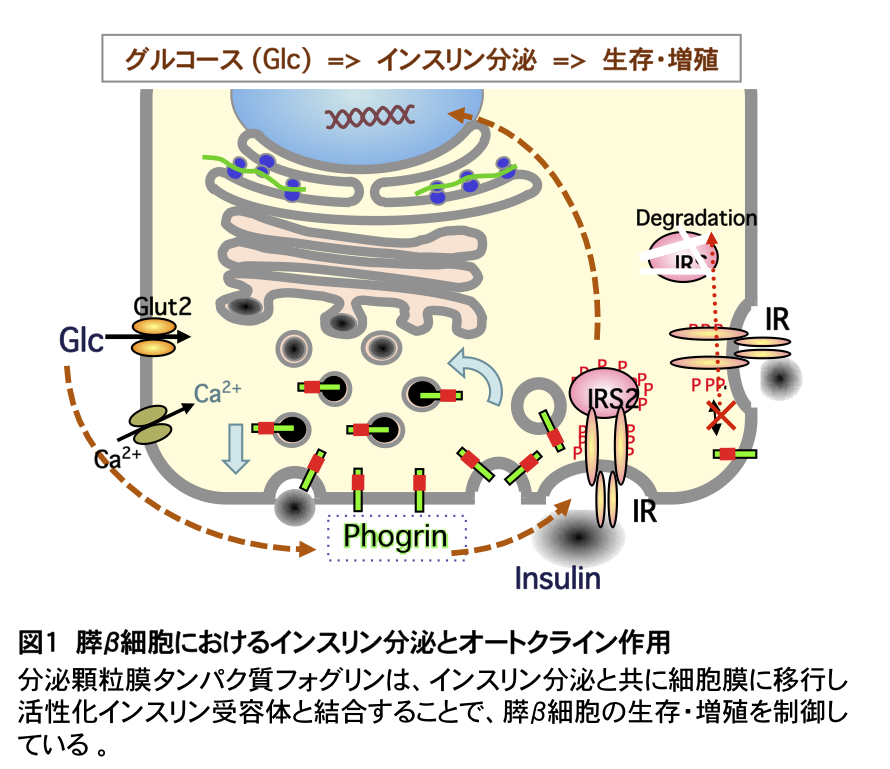
グルコース(血糖)は膵β細胞からのインスリン分泌を促すだけでなく、細胞増殖を誘導することが知られ、この連関機構の解明は糖尿病の病態を理解するために重要である。分泌顆粒蛋白質フォグリンは、分泌インスリンによるオートクライン作用を特異的に制御することでストレス下のβ細胞増殖を調節している(図1)。フォグリンを制御する方法が分かれば、2型糖尿病の予防や治療法の開発につながる可能性がある。
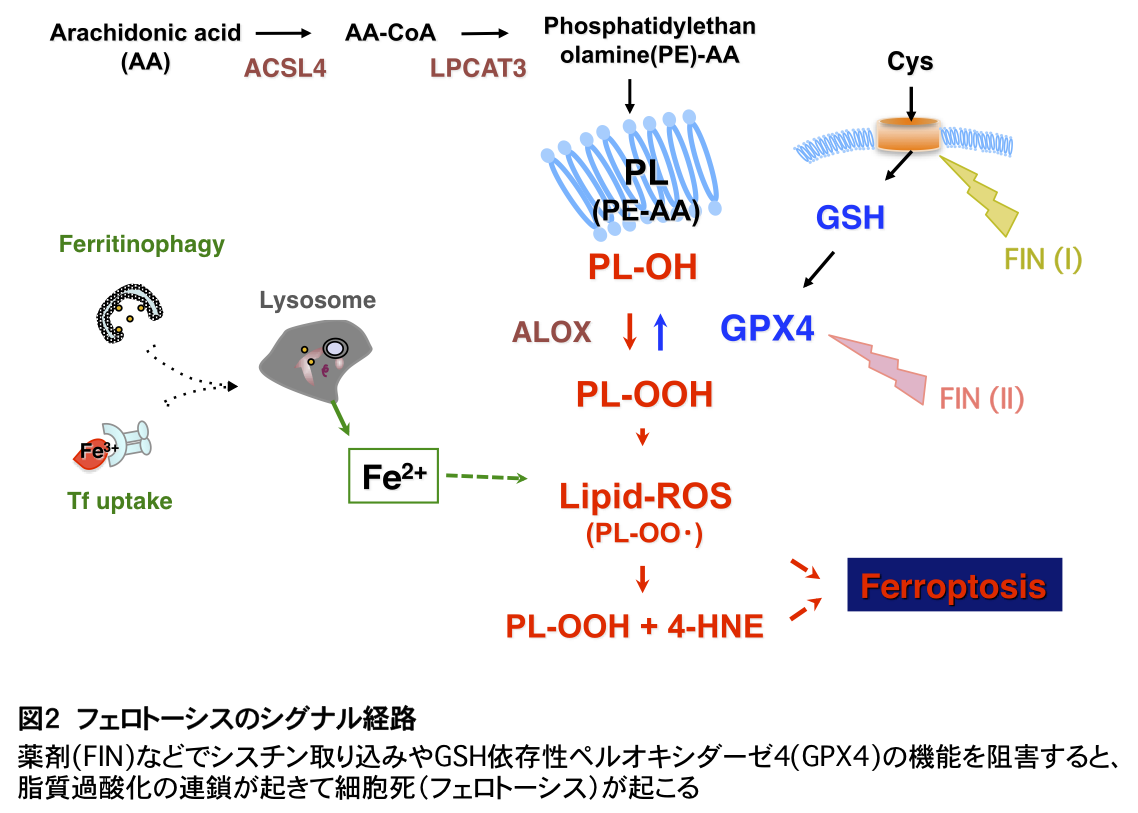
私たちは以前、虚血性の神経細胞死に、ミトコンドリアに加えてリリソソーム由来の活性酸素種が関与することを見出した。現在、さまざまな病態に関わることが示唆されている新しい細胞死フェロトーシスの機構解明に取り組んでいる(図2)。
2. 内分泌細胞のホルモン分泌顆粒の形成、維持、放出機構の研究
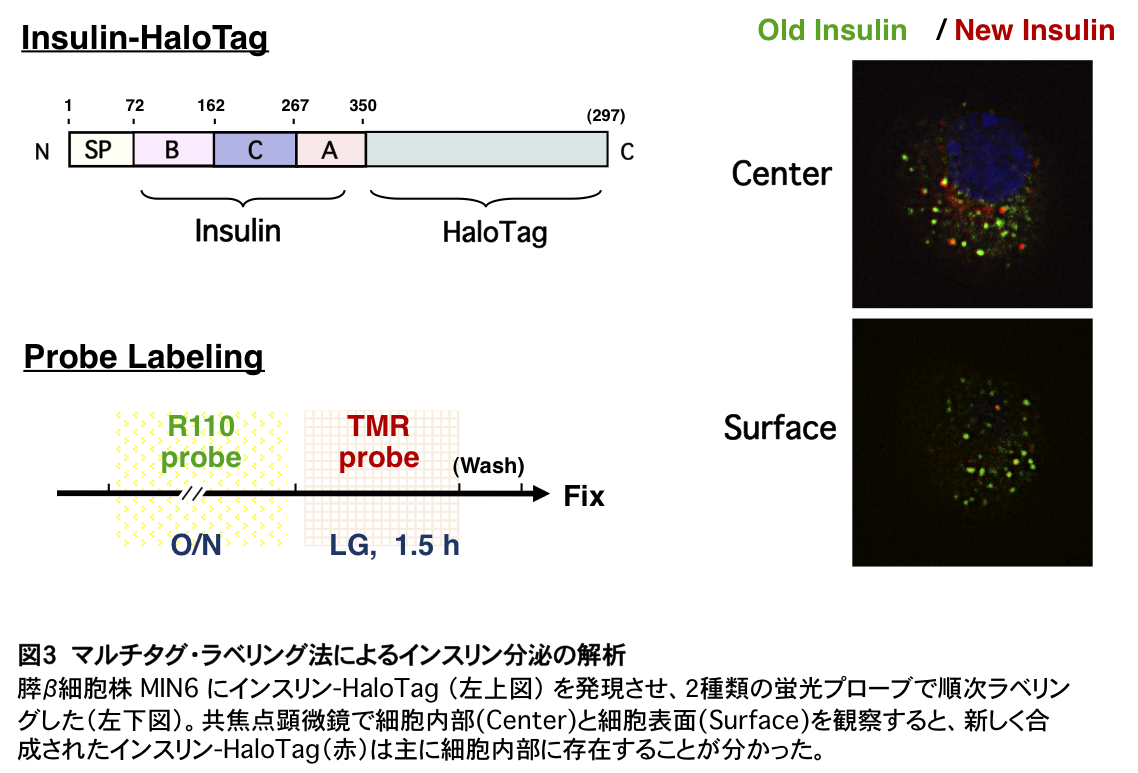
分泌蛋白質や膜蛋白質は粗面小胞体で生合成されたのち、小胞輸送機構によりゴルジ体以降のオルガネラに輸送される。そのうちホルモンやその修飾酵素はトランス・ゴルジ・ネットワーク(TGN)において他の蛋白質と選別され、内分泌細胞に特有の分泌顆粒へと移行し貯留される。私たちは分泌顆粒に特異的な蛋白質であるフォグリン、セクレトグラニンIII、そして分泌顆粒を構成する膜成分のコレステロールに注目し、その機能解析を通じてホルモン選別輸送と分泌顆粒形成のしくみを明らかにしてきた。最近、蛍光を使った新しい解析システムを立ち上げ、ホルモン分泌能の維持機構の研究を進めている(図3)。
3. 低分子プローブを利用した細胞機能および疾患病態の解析
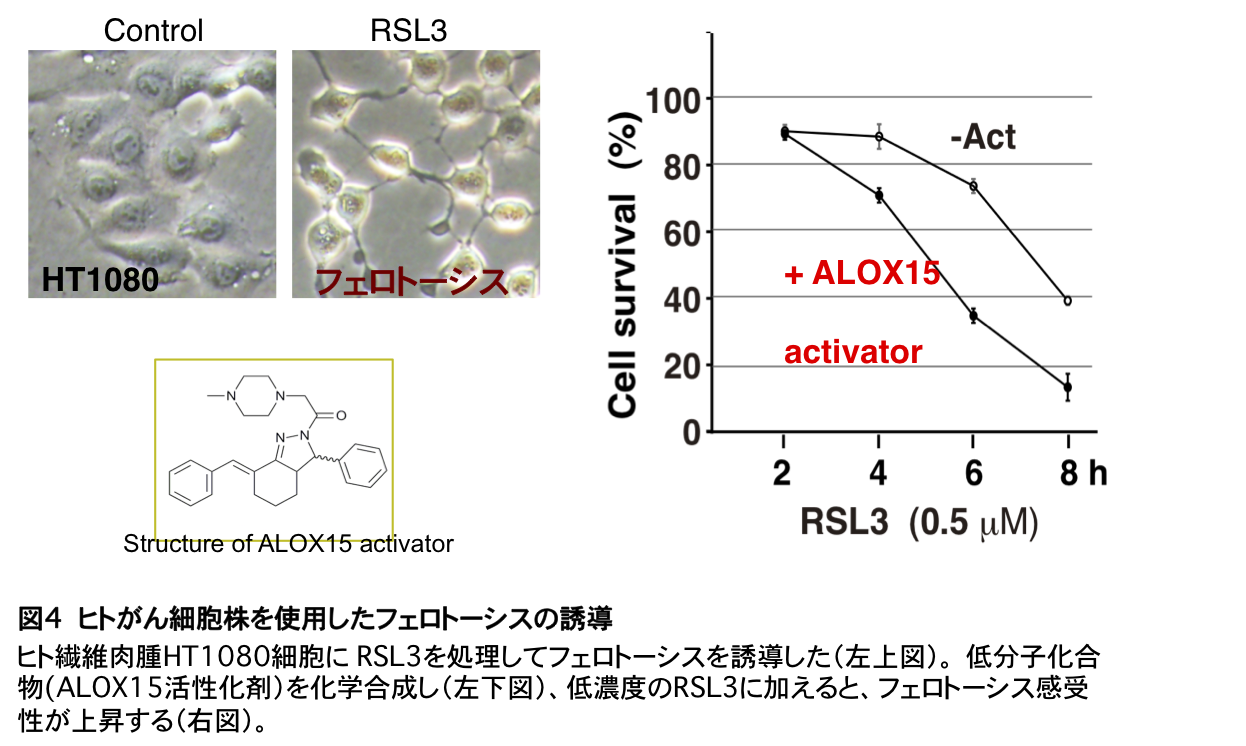
理工学部の連携研究者によって新しく開発された発光プローブを使用し、生体情報を可視化するイメージング研究を行っている。また共同研究者が開発した低分子化合物(薬剤)について、抗腫瘍活性の測定などを行っている(図4)。
Specific aims:
To elucidate formation mechanisms for highly integrated functions of differentiated cells such as pancreatic β-cells and neuronal cells with use of molecular and cellular technical approaches.
Projects (~2016):
1. Mechanisms on peptide hormones secretion and secretory granule formation in endocrine cells.
Peptide hormones synthesized at the endoplasmic reticulum are transported to the trans-Golgi network (TGN) where they are sorted and specifically targeted to secretory granules in neuroendocrine cells. We found that secretory granule protein, phogrin, binds to CPE and clathrin adaptors through the luminal region and the cytoplasmic tail, respectively, suggesting that this transmembrane protein has a role in hormone sorting by providing a communication device between the granule lumen and the cytosol. We further investigate the regulatory secretion and degradation of peptide hormones using a recently developed multi-tag imaging system.
2. Mechanisms on growth, survival, and cell death in pancreatic β-cells and neuronal cells.
We have discovered that phogrin functions as a regulatory mediator bridging between glucose/insulin secretion and autocrine insulin signaling in the growth of pancreatic β-cells. We are analyzing its physiological role with use of the gene-targeted mouse. In addition, we investigate the signaling pathway of novel necrotic cell death such as necroptosis and ferroptosis with tumor cells or neuronal cells.
3. Development of fluorescent or luminescent probes for investigating various diseases.
In a collaborative study with some engineering groups, we are developing fluorescent or luminescent probes to dissect molecular mechanisms of dysfunction in cancer, diabetes, and other diseases. We demonstrated previously that reactive oxygen species are localized at autophagosomes/lysosomes in a basal state and they are eventually implicated to neuronal cell death by cerebral ischemia.
私たちは以前、虚血性の神経細胞死に、ミトコンドリアに加えてリリソソーム由来の活性酸素種が関与することを見出した。現在、さまざまな病態に関わることが示唆されている新しい細胞死フェロトーシスの機構解明に取り組んでいる(図2)。


2. 内分泌細胞のホルモン分泌顆粒の形成、維持、放出機構の研究
分泌蛋白質や膜蛋白質は粗面小胞体で生合成されたのち、小胞輸送機構によりゴルジ体以降のオルガネラに輸送される。そのうちホルモンやその修飾酵素はトランス・ゴルジ・ネットワーク(TGN)において他の蛋白質と選別され、内分泌細胞に特有の分泌顆粒へと移行し貯留される。私たちは分泌顆粒に特異的な蛋白質であるフォグリン、セクレトグラニンIII、そして分泌顆粒を構成する膜成分のコレステロールに注目し、その機能解析を通じてホルモン選別輸送と分泌顆粒形成のしくみを明らかにしてきた。最近、蛍光を使った新しい解析システムを立ち上げ、ホルモン分泌能の維持機構の研究を進めている(図3)。

3. 低分子プローブを利用した細胞機能および疾患病態の解析
理工学部の連携研究者によって新しく開発された発光プローブを使用し、生体情報を可視化するイメージング研究を行っている。また共同研究者が開発した低分子化合物(薬剤)について、抗腫瘍活性の測定などを行っている(図4)。

Specific aims:
To elucidate formation mechanisms for highly integrated functions of differentiated cells such as pancreatic β-cells and neuronal cells with use of molecular and cellular technical approaches.
Projects (~2016):
1. Mechanisms on peptide hormones secretion and secretory granule formation in endocrine cells.
Peptide hormones synthesized at the endoplasmic reticulum are transported to the trans-Golgi network (TGN) where they are sorted and specifically targeted to secretory granules in neuroendocrine cells. We found that secretory granule protein, phogrin, binds to CPE and clathrin adaptors through the luminal region and the cytoplasmic tail, respectively, suggesting that this transmembrane protein has a role in hormone sorting by providing a communication device between the granule lumen and the cytosol. We further investigate the regulatory secretion and degradation of peptide hormones using a recently developed multi-tag imaging system.
2. Mechanisms on growth, survival, and cell death in pancreatic β-cells and neuronal cells.
We have discovered that phogrin functions as a regulatory mediator bridging between glucose/insulin secretion and autocrine insulin signaling in the growth of pancreatic β-cells. We are analyzing its physiological role with use of the gene-targeted mouse. In addition, we investigate the signaling pathway of novel necrotic cell death such as necroptosis and ferroptosis with tumor cells or neuronal cells.
3. Development of fluorescent or luminescent probes for investigating various diseases.
In a collaborative study with some engineering groups, we are developing fluorescent or luminescent probes to dissect molecular mechanisms of dysfunction in cancer, diabetes, and other diseases. We demonstrated previously that reactive oxygen species are localized at autophagosomes/lysosomes in a basal state and they are eventually implicated to neuronal cell death by cerebral ischemia.
